Elektronisches Wechselspiel in metallreichen Verbindungen
Forschungsbericht (importiert) 2004 - Max-Planck-Institut für Festkörperforschung
Der Rahmen chemischer Forschung ist durch das Periodensystem der Elemente vorgegeben, dem die systematische Auffüllung der Elektronen-„Schalen“ zugrunde liegt. Nach dem Charakter der jeweiligen Schalen unterscheidet man s-, p-, d- und f-Elemente.
Besonders ein Element sticht aus dem Periodensystem hervor: Kohlenstoff. Die ungeheure Fülle von Verbindungen in der organischen Chemie wie auch – nimmt man die molekularen Fullerene hinzu – die kaum benennbare Anzahl von Elementmodifikationen beruht letztlich auf der Fähigkeit des Kohlenstoffatoms, gerichtete Bindungen zu anderen Kohlenstoffatomen einzugehen. Trotz ihrer Ausnahmestellung im Quantitativen unterliegt die Kohlenstoffchemie jedoch einer einschneidenden qualitativen Beschränkung, weil lediglich s- und p-Elektronen an der chemischen Bindung beteiligt sind. Diese Einschränkung entfällt bei den schweren Elementen, insbesondere den Metallen, die die Mehrheit im Periodensystem bilden. Es hat sich gezeigt, dass vor allem die d-Metalle die Fähigkeit zur Ausbildung gerichteter Metall-Metall-Bindungen haben. In den vergangenen Jahrzehnten entstand eine umfangreiche Chemie von Cluster-Verbindungen und Systemen mit kondensierten Clustern, wobei in letzteren Metallcluster die Bausteine für ein-, zwei- oder dreidimensional vernetzte Strukturen bilden [1].
Mit metallreichen Verbindungen der Seltenerdelemente öffnet sich eine ausgedehnte neue Chemie, in der diese f-Metalle sich wie d-Elemente verhalten [2]. Inzwischen kennt man eine Vielzahl von Verbindungen, in denen sich das Wechselspiel von s-, p-, d- und f-Elektronen untersuchen lässt. Von besonderem Interesse ist die gegenseitige Beeinflussung von f- und d-Elektronensystemen in metallreichen Verbindungen der Seltenerdmetalle wegen der Vielfalt resultierender physikalischer Phänomene. Grundlage hierfür bildet die sehr unterschiedliche Natur von f- und d-Elektronen. Die d-Elektronen gehen Bindungen zwischen den Metallatomen ein und können in diskreten Bindungen lokalisiert, aber auch in einem ausgedehnten Bindungsnetz delokalisiert sein. Dagegen nehmen die f-Elektronen in aller Regel nicht an Bindungen teil, sind vielmehr stets am Metallatom lokalisiert und verleihen diesem vielfach ein hohes magnetisches Moment. Zwei Beispiele aus der Chemie des Gadoliniums mit halbgefüllter f-Schale und dem hohen Moment von sieben Elektronen am Gd-Atom bzw. Gd3+-Ion sollen im Folgenden die wechselweise Beeinflussung dieser verschiedenartigen Elektronensysteme veranschaulichen.
Gadolinium bildet metallreiche Carbidhalogenide mit der Zusammensetzung Gd2XC (X = Cl, Br, I), deren atomarer Aufbau in Abbildung 1 (links) gezeigt ist. Mit C-Atomen gefüllte Doppelschichten aus Gd-Atomen alternieren mit Schichten aus Halogen-Atomen. Pro Formeleinheit verbleibt ein überschüssiges (d-)Elektron (Abb. 1, rechts). Die zusätzlichen Elektronen gehen Bindungen innerhalb und zwischen den Netzen aus Metall-Atomen ein und verleihen den Verbindungen metallischen Charakter. Interessanterweise lässt sich das zusätzliche Elektron durch Einlagerung von Wasserstoff binden und durch Reaktion mit dem Gas geradezu bis zur klassischen Zusammensetzung des salzartigen Gd2XHC „titrieren“.
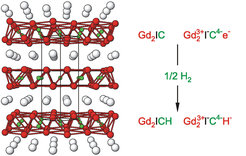
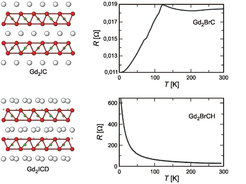
Neutronenstreuung – aus messtechnischen Gründen wurde sie an den strukturgleichen Deuteriden des sehr ähnlichen Nachbarelements Terbium durchgeführt – ergibt (Abb. 2, links), dass die reversible Reaktion mit Wasserstoff unter Auflösung der Metall-Metall-Bindungen, jedoch unter weitgehender Beibehaltung der Struktur abläuft. Sie ist jedoch mit drastischen Änderungen im elektrischen Verhalten verbunden (Abb. 2, rechts). Durch die Bindung der freien Elektronen an die Wasserstoffatome steigt der elektrische Widerstand um nahezu fünf Größenordnungen an. Die Messung des magnetischen Verhaltens zeigt, dass die Anomalie im Widerstand von metallischem Gd2BrC bei etwa 120 K von einer ferromagnetischen Ordnung der Momente der f-Elektronen bei dieser Temperatur herrührt, d.h., die Momente richten sich parallel aus. Im Isolator Gd2BrCH tritt die magnetische Ordnung erst bei einer um zwei Größenordnungen niedrigeren Temperatur ein. Der Unterschied macht deutlich, dass die Bindung der Metallatome über d-Elektronen zu einer starken Kopplung der Momente der f-Elektronen führt. Diese Kopplung über Leitungselektronen ist zu erwarten, doch zeigen weitergehende Untersuchungen, dass f-Elektronensysteme auch über lokalisierte Metall-Metall-Bindungen stark gekoppelt werden.
Behandelt das voranstehende Beispiel den Einfluss der d-Elektronen auf das System der f-Elektronen, so macht das zweite den Einfluss in umgekehrter Richtung deutlich.
Das metallreiche Iodid GdI2 besitzt eine sehr einfache Struktur, in der planare Dreiecknetze der Gd-Atome mit Doppelschichten aus I-Atomen alternieren. Die Formulierung Gd3+ (I–)2e– lässt den metallischen Charakter verstehen. Die gegenüber Gd2XC größere Zahl freier Elektronen pro Metallatom führt zu einer noch stärkeren Kopplung der Momente der lokalisierten f-Elektronen, sodass GdI2 bereits nahe Raumtemperatur ferromagnetisch ordnet. Der Übergang wird von einem auffallenden Maximum im elektrischen Widerstand begleitet, vergleiche Abbildung 3. Berechnungen der elektronischen Struktur ergeben eine ausgeprägte Anomalie für die Leitungsbänder (van-Hove-Singularität), die auf dem zweidimensionalen Charakter des Systems beruht. Unsere daraus abgeleitete Voraussage einer starken Magnetfeldabhängigkeit des elektrischen Widerstandes nahe der Ordnungstemperatur ließ sich experimentell eindrucksvoll bestätigen [3].
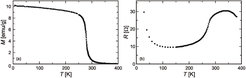
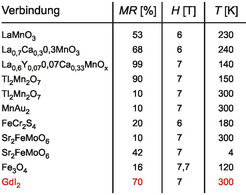
Abbildung 4 zeigt die starke Erniedrigung des elektrischen Widerstandes in äußeren Magnetfeldern. In der Tabelle in Abbildung 5 wird der Magnetwiderstand von GdI2 mit dem anderer Materialien verglichen, die so genanntes „Colossal Magneto-Resistance (CMR)“-Verhalten zeigen und wegen ihrer Nähe zur Anwendung in Magnetspeichersystemen weltweit intensiv untersucht werden. Dem Effekt liegt stets ein heterogenes elektronisches System zugrunde, in dem der lokalisierte ferromagnetisch ordnende Anteil den delokalisierten Anteil der Leitungselektronen polarisiert. Modellrechnungen für GdI2 belegen die starke Rückwirkung der ordnenden f-Elektronen auf die d-Elektronen im Leitungsband [4].
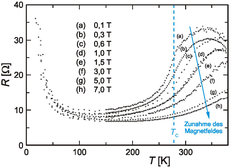
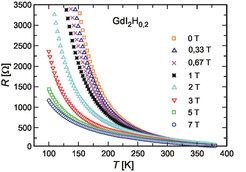
Eingangs wurde das große Spektrum interessanter physikalischer Phänomene beim Spiel mit der d-f Wechselwirkung angedeutet; Untersuchungen an GdI2 mögen dies illustrieren [5]. Wie Gd2XC lässt sich auch GdI2 mit Wasserstoff bis zur Grenzzusammensetzung GdI2H „titrieren“. Durch die Lokalisierung freier Elektronen unter Bildung des H–-Ions steigt der elektrische Widerstand stark an, und erwartungsgemäß sinkt die magnetische Ordnungstemperatur. Allerdings tritt der CMR-Effekt bei tiefer Temperatur drastisch verstärkt auf (Abb. 6).
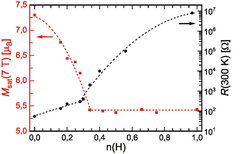
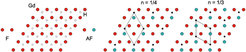
Die genaue Untersuchung des gesamten Systems GdI2Hn fördert weitere Überraschungen zutage, vergleiche Abbildung 7. Während der elektrische Widerstand mit zunehmendem Wasserstoffgehalt kontinuierlich ansteigt, zeigt das magnetische Verhalten, dass der Einbau von Wasserstoff mehr als die „Neutralisation“ freier Elektronen bewirkt, denn das magnetische Sättigungsmoment sinkt bis zur Zusammensetzung n ≈ 1/3 und bleibt bei weiter zunehmendem Wasserstoffgehalt konstant. Der Grund liegt darin, dass in der Umgebung eines H-Atoms statt der ferromagnetischen eine antiferromagnetische Ordnung mit jeweils entgegengesetzter Ausrichtung der Momente bevorzugt wird. In Verbindung mit dem Dreiecksnetz der Gd-Atome führt dies zur Spinfrustration; denn im Dreieck können jeweils nur zwei antiparallele neben einer parallelen Konfiguration vorliegen. Bei einem geordneten Einbau von Wasserstoff ist die frustrierte Spinkonfiguration für alle Dreiecke bei n = 1/3 erreicht, und die weitere Einlagerung von Wasserstoff ändert daran nichts mehr, wie eine der möglichen in Abbildung 8 gezeigten Konfigurationen zeigt.
Die hier nur exemplarisch herausgegriffenen Verbindungen vermitteln einen Eindruck von einem breiten Forschungsfeld, das neben vielen neuartigen Verbindungen eine Fülle ungewöhnlicher physikalischer Phänomene beinhaltet, die von elektronischer Delokalisierung/Lokalisierung mit Metall-Halbleiter-Übergängen über Ordnungsvorgänge in niedrig-dimensionalen Systemen bis hin zu Spinglas-Verhalten reicht.







